一、原子结构示与性质
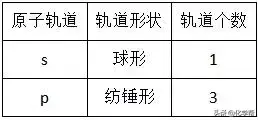
1、能层、能级与原子轨道
(1)能层(n):在多电子原子中,核外电子的能量是不同的,按照电子的能量差异将其分成不同能层。通常用K、L、M、N、O、P、Q……表示相应的第一、二、三、四、五、六、七……能层,能量依次升高
(2)能级:同一能层里的电子的能量也可能不同,又将其分成不同的能级,通常用s、p、d、f等表示,同一能层里,各能级的能量按s、p、d、f的顺序升高,即E(s)<E(p)<E(d)<E(f)。
(3)原子轨道:表示电子在原子核外的一个空间运动状态。电子云轮廓图给出了电子在核外经常出现的区域,这种电子云轮廓图也就是原子轨道的形象化描述。
2、基态原子的核外电子排布的三原理
(1)能量最低原理:原子的电子排布遵循构造原理能使整个原子的能量处于最低状态。
(2)泡利原理:在一个原子轨道中,最多只能容纳2个电子,并且这两个电子的自旋方向相反。
(3)洪特规则:当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据1个轨道,并且自旋方向相同。洪特规则特例:当能量相同的原子轨道在全满(p6、d10、f14)、半满(p3、d5、f7)和全空 (p0、d0、f0)状态时,体系的能量最低,如:24Cr的电子排布式为1s22s22p63s23p63d54s1。
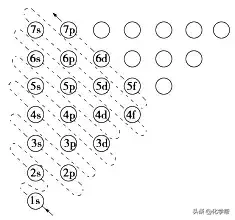
3、构造原理:绝大多数元素的原子核外电子的排布将遵循如下图所示的排布顺序,人们把它称为构造原理。
4、电离能和电负性
(1)电离能
含义:第一电离能:气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,符号I,单位kJ/mol。
变化规律:
①同周期:第一种元素的第一电离能最小,最后一种元素的第一电离能最大,总体呈现从左至右逐渐增大的变化趋势。
②同族元素:从上至下第一电离能逐渐减小。
③同种原子:逐级电离能越来越大(即I1≤I2≤I3…)。
(2)电负性
含义:不同元素的原子在化合物中吸引键合电子能力的标度。元素的电负性越大,表示其原子在化合物中吸引键合电子能力的能力越强。
标准:以最活泼的非金属氟的电负性为4.0和锂的电负性为1.0作为相对标准,计算得出其他元素的电负性(稀有气体未计)。
变化规律:
①金属元素的电负性一般小于1.8,非金属元素的电负性一般大于1.8,而位于非金属三角区边界的“类金属”(如锗、锑等)的电负性则在1.8左右,它们既有金属性又有非金属性。
②在元素周期表中,同周期从左至右,元素的电负性逐渐增大,同主族从上至下,元素的电负性逐渐减小。
方法技巧:
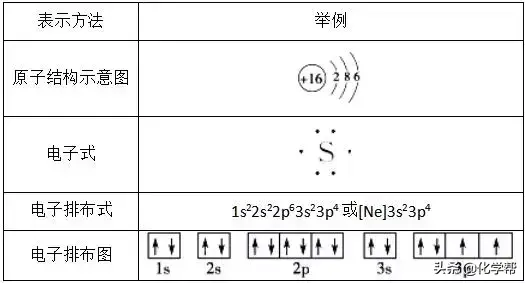
1、原子的核外电子排布式(图)的书写
(1)核外电子排布式:用数字在能级符号右上角表明该能级上排布的电子数。例如,K:1s22s22p63s23p64s1。为了简化,通常把内层已达稀有气体电子结构的部分称为“原子实”,用该稀有气体的元素符号加方括号来表示。例如,K:[Ar]4s1。
(2)核外电子排布图:用□表示原子轨道,↑和↓分别表示两种不同自旋方向的电子。如氧原子的核外电子排布图可表示为

核外电子排布图能直观地反映出原子的核外电子的自旋情况以及成对电子对数和未成对的单电子数。
(3)价电子排布式:如Fe原子的电子排布式为1s22s22p63s23p63d64s2,价电子排布式为3d64s2。价电子排布式能反映基态原子的能层数和参与成键的电子数以及最外层电子数。
(4)构造原理是书写基态原子的电子排布式的依据,也是绘制基态原子的电子排布图的主要依据之一。
2、基态原子的核外电子排布的表示方法(以硫原子为例)
3、电离能的应用:
①判断金属性与非金属性强弱;
②分析原子核外电子层结构,如某元素的In+1≫In,则该元素的最外层电子数为n;③判断化学键类型。
4、电负性的应用:
①判断一种元素是金属元素还是非金属元素,以及金属性与非金属性的强弱;
②判断元素在化合物中的价态;
③判断化学键类型。
二、分子结构与性质
1、共价键类型
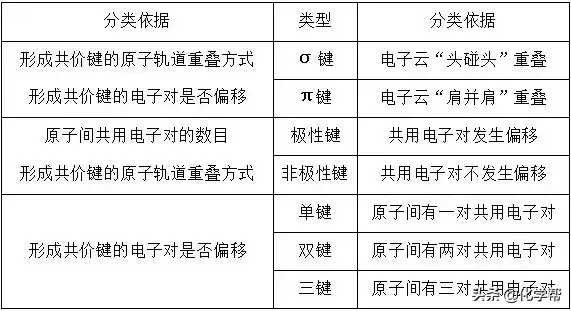
2、分子的立体构型与性质
(1)价层电子对互斥模型
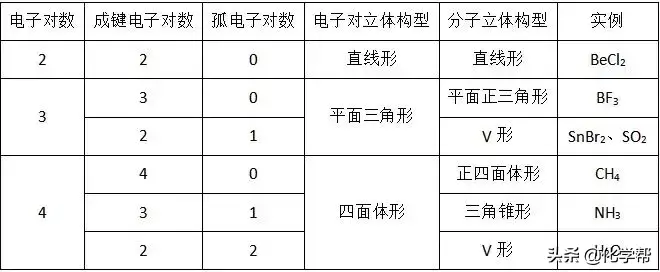
注意:
运用价层电子对互斥模型可预测分子或离子的立体结构,但要注意判断其价层电子对数,对ABm型分子或离子,其价层电子对数的判断方法为:n=(中心原子的价电子数+每个配位原子提供的价电子数×m)/2
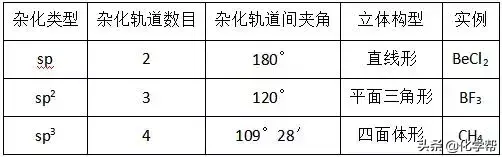
(2)杂化轨道类型与分子立体构型
(3)分子的极性:分子中正电中心和负电中心重合的分子是非极性分子,分子中正电中心和负电中心不重合的分子是极性分子。
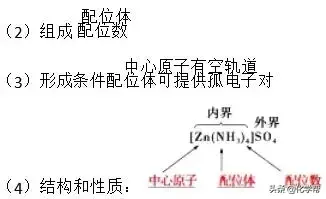
3、配合物的组成、结构、性质
(1)概念:由金属离子(或原子)与某些分子或离子(称为配体)以配位键结合而成的化合物。
4、分子间作用力与物质性质:分子间作用力最常见的是范德华力和氢键,其中范德华力<氢键<化学键。
(1)范德华力主要影响物质的熔点、沸点、硬度等物理性质。范德华力越强,物质的熔点、沸点越高,硬度越大。一般来说, 结构和组成相似的物质,随着相对分子质量的增加,范德华力逐渐增大,分子的极性越大,范德华力也越大。
(2)氢键:已经与电负性很强的原子形成共价键的氢原子(该氢原子几乎为裸露的质子)与另一个分子中电负性很强的原子之间的作用力,称为氢键。表示方法:A—H…B。氢键具有一定的方向性和饱和性。:氢键包括分子内氢键和分子间氢键两种。分子间氢键对物质性质的影响:主要表现为使物质的熔、沸点升高,对电离和溶解度等产生影响。
方法技巧
(1)怎样判断化学键的类型和数目?
①只有两原子的电负性相差不大时,才能形成共用电子对,形成共价键,当两原子的电负性相差很大(大于1.7)时,不会形成共用电子对,这时形成离子键。
②通过物质的结构式,可以快速有效地判断共价键的种类及数目;判断成键方式时,需掌握:共价单键全为σ键,双键中有一个σ键和一个π键,三键中有一个σ键和两个π键。
(2)三点说明:
①s轨道与s轨道重叠形成σ键时,电子不是只在两核间运动,而是电子在两核间出现的概率增大。
②因s轨道是球形的,故s轨道和s轨道形成σ键时,无方向性。两个s轨道只能形成σ键,不能形成π键。
③两个原子间可以只形成σ键,但不能只形成π键。
(3)分子极性判断:分子中的中心原子的最外层电子若全部成键,此分子一般为非极性分子;分子中的中心原子的最外层电子若未全部成键,此分子一般为极性分子。如CH4、BF3、CO2等分子中的中心原子的最外层电子均全部成键,它们都是非极性分子。而H2O、NH3、NF3等分子中的中心原子的最外层电子均未全部成键,它们都是极性分子。
(4)含氧酸酸性比较:同种元素的含氧酸的强弱规律,其酸性具有如下规律:对于同一种元素的含氧酸来说,该元素的化合价越高,其含氧酸的酸性越强。
(5)氢键应用要注意:
①有氢键的分子间也有范德华力,但有范德华力的分子间不一定有氢键。
②一个氢原子只能形成一个氢键,这就是氢键的饱和性。
③分子内氢键基本上不影响物质的性质。
(6)判断分子的中心原子杂化轨道类型的方法
①根据杂化轨道的空间分布构型判断:若杂化轨道在空间的分布为正四面体或三角锥形,则分子的中心原子发生sp3杂化;若杂化轨道在空间的分布呈平面三角形,则分子的中心原子发生sp2杂化;若杂化轨道在空间的分布呈直线形,则分子的中心原子发生sp杂化。
(2)根据杂化轨道之间的夹角判断:若杂化轨道之间的夹角为109°28′,则分子的中心原子发生sp3杂化;若杂化轨道之间的夹角为120°,则分子的中心原子发生sp2杂化;若杂化轨道之间的夹角为180°,则分子的中心原子发生sp杂化。
(3)记住常见的一些典型分子中中心原子的杂化方式。
三、晶体结构与性质
方法技巧
一、晶体判断
1、依据构成晶体的微粒和微粒间的作用判断
(1)离子晶体的构成微粒是阴、阳离子,微粒间的作用是离子键。
(2)原子晶体的构成微粒是原子,微粒间的作用是共价键。
(3)分子晶体的构成微粒是分子,微粒间的作用为分子间作用力。
(4)金属晶体的构成微粒是金属阳离子和自由电子,微粒间的作用是金属键。
2、依据物质的分类判断
(1)金属氧化物(如K2O等)、强碱(NaOH、KOH等)和绝大多数的盐类是离子晶体。
(2)大多数非金属单质(除金刚石、石墨、晶体硅等)、非金属氢化物、非金属氧化物(除SiO2外)、几乎所有的酸、绝大多数有机物(除有机盐外)是分子晶体。
(3)常见的原子晶体单质有金刚石、晶体硅、晶体硼等,常见的原子晶体化合物有碳化硅、二氧化硅 等。
(4)金属单质是金属晶体。
3、依据晶体的熔点判断
(1)离子晶体的熔点较高,常在数百至一千摄氏度以上。
(2)原子晶体熔点高,常在一千摄氏度至几千摄氏度。
(3)分子晶体熔点低,常在数百摄氏度以下至很低温度。
(4)金属晶体多数熔点高,但也有相当低的。
4、依据导电性判断
(1)离子晶体溶于水形成的溶液及熔融状态时能导电。
(2)原子晶体一般为非导体。
(3)分子晶体为非导体,而分子晶体中的电解质(主要是酸和强极性非金属氢化物)溶于水,使分子内的化学键断裂形成自由移动的离子,也能导电。
(4)金属晶体是电的良导体。
5、依据硬度和机械性能判断:离子晶体硬度较大且脆。原子晶体硬度大。分子晶体硬度小且较脆。金属晶体多数硬度大,但也有较低的,且具有延展性。
二、晶体熔沸点判断
1、不同类型晶体的熔、沸点高低一般规律:原子晶体>离子晶体>分子晶体。金属晶体的熔、沸点差别很大,如钨、铂等沸点很高,如汞、镓、铯等沸点很低,金属晶体一般不参与比较。
2、原子晶体:由共价键形成的原子晶体中,原子半径小的键长短,键能大,晶体的熔、沸点高。如熔点:金刚石>碳化硅>硅。
3、离子晶体:一般地说,阴、阳离子所带电荷数越多,离子半径越小,则离子间的作用就越强,其离子晶体的熔、沸点就越高,如熔点:MgO>MgCl2>NaCl>CsCl。
4、分子晶体:
(1)分子间作用力越大,物质的熔、沸点越高;具有氢键的分子晶体,熔、沸点反常地高。如H2O>H2Te>H2Se>H2S。
(2)组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高,如SnH4>GeH4>SiH4>CH4,F2<Cl2<Br2<I2。
(3)组成和结构不相似的物质(相对分子质量接近),分子的极性越大,其熔、沸点越高,如CO>N2,CH3OH>CH3CH3。
(4)同分异构体,支链越多,熔、沸点越低。
(5)同分异构体的芳香烃,其熔、沸点高低顺序是邻>间>对位化合物。
6、金属晶体:金属离子半径越小,离子电荷数越多,其金属键越强,金属熔、沸点就越高,如熔、沸点:Na<Mg<Al,Li>Na>K>Rb>Cs。
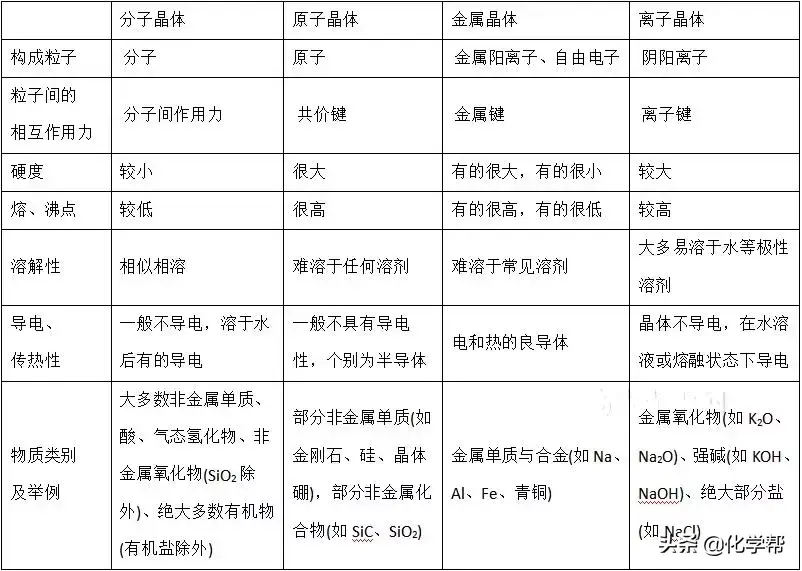
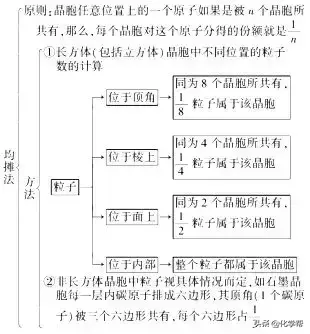
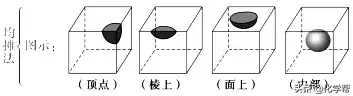
三、晶胞中微粒的计算方法——均摊法

杜里万多肉为什么贵(你不知道的多肉杜里万)
橘红色的杜里万多肉杜里万介绍:杜里万即是杜里万莲的简称,它原产于墨西哥,是一款非常有名的暗纹系多肉。杜里万的叶片多呈半圆柱状,特别的厚实,叶面带有暗纹,其顶端有较长的叶尖,平常它的叶片颜色为淡绿色或淡白色,在光照充足且温差较大的环境则会变成红色、褐红色或橘红色,十分好看。红色的杜里万杜里万莲究竟有几 2025-04-01 10:36:22
国家为什么拆违建(老旧小区改造为什么要拆除违章搭建?)
在我们身边,老旧小区随处可见。记得小时候的那些日子,邻里之间的欢声笑语、门前的小花小草,都是我们对于家的美好回忆。然而,随着社会的发展,很多老旧小区由于设施老化、环境恶化、功能不全等问题,亟待进行改造。尤其是小区里那些“违章搭建”的建筑,更是在这个过程中成为了一个重要的话题。那么,为什么老旧小区改造 2025-04-01 08:50:04
白鹤芋为什么不开花(白鹤芋不开花别急着扔)
这个网友猜的问题其实正中白鹤芋的弱点,白鹤芋也叫“白掌”,因为开花难而又名“安祖花”。但其实白鹤芋是个好养的植物,只要遵照养花性格,它一定能有自己的美丽绽放。那么白鹤芋经过什么过程才能开花呢?对于网友提出的问题,应该如何回复才算准确呢?关于白鹤芋。白鹤芋又名白掌、安祖花,属于一种天南星科花卉植物,原 2025-04-01 06:57:30
小区为什么要物业(小区为什么离不开物业公司?)
【引言】最近这几年,越来越多业主对物业的服务感到不满,不仅服务差、收费高,那服务态度更是一言难尽,明明自己是花钱买服务可最后服务不满意还要受一肚子的气,为此更是有不少业主嚷嚷着要“取消物业”。可就目前来看绝大多数小区都不具备取消物业的条件,贸然取消到最后难受的可能还是业主自己,毕竟物业服务的专业性、 2025-04-01 05:12:02
为什么五月不动土(为何五月不能建房?)
在古代的时候,古人是十分避讳五月份的,甚至可以说是对五月份是有点害怕的,就是因为这个月份有太多的忌讳了。在民间就有一种说法,这也是古人传下来的,那就是“五月不起屋,起屋主发秃”。这里的五月也是指农历五月份,它的意思是说最好不要在农历五月份建房子,如果一定要在这个月份建房子,那房子主人就容易秃顶。这又 2025-04-01 02:09:52
为什么石墨能导电(石墨材料的物理性质有哪些?)
石墨材料具有一系列独特的物理性质,主要包括以下几点:颜色与外观:石墨呈深灰色至黑色,具有金属光泽,质软且滑腻。导电性和导热性:石墨是一种良好的导体,其导电性优于一般的非金属材料,但略低于金属导体。此外,石墨的导热性也非常好,其导热系数远高于一般的非金属材料,甚至可以达到某些金属材料的水平。耐高温性: 2025-03-31 09:28:32