1、氢氧燃料电池
在U形管中加入1mol/L的Na2SO4溶液,并滴入2滴酚酞溶液。用导线将两根石墨棒与电流表相连,组装成如图所示的电路。
向两边的石墨棒上分别通入氢气和氧气。

电流表指针发生偏转,通入氧气的石墨棒附近的溶液变红色。反应一段时间后,停止通入气体,振荡U形管,红色褪去。

通氧气的一端是正极区,反应过程中生成


2、乙醇燃料电池
将上面装置中的氢气换成乙醇蒸气,电解质溶液换成KOH溶液,其它不变。
同样可以看到电流表的指针发生偏转,说明也形成了燃料电池。乙醇在负极失电子,生成二氧化碳,但电解质是KOH,会与CO2反应生成K2CO3。

3、乙烯催化氧化成乙醛(CH3CHO)可设计成如图所示的燃料电池,请回答下列问题。

(1)请在装置图中标出正、负极和反应物。
(2)分析电池中电子的移动方向:_________,电解质溶液中
(3)写出此燃料电池的正极反应式:_____________,总反应式:_________。
(4)若有2 mol乙烯参与反应,理论上转移的电子数为________。
答案:
(1)

(2)电极a→导线→电极b 从左向右

分析:
结合原电池的工作原理和装置图,a是负极,b是正极,磷酸作电解质。
负极上乙烯失电子生成乙醛,从组成上看是得1个氧原子,相当于失去2个电子,电极反应式为:

正极上氧气得电子:
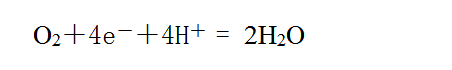
两式叠加得总反应式。

杜里万多肉为什么贵(你不知道的多肉杜里万)
橘红色的杜里万多肉杜里万介绍:杜里万即是杜里万莲的简称,它原产于墨西哥,是一款非常有名的暗纹系多肉。杜里万的叶片多呈半圆柱状,特别的厚实,叶面带有暗纹,其顶端有较长的叶尖,平常它的叶片颜色为淡绿色或淡白色,在光照充足且温差较大的环境则会变成红色、褐红色或橘红色,十分好看。红色的杜里万杜里万莲究竟有几 2025-04-01 10:36:22
国家为什么拆违建(老旧小区改造为什么要拆除违章搭建?)
在我们身边,老旧小区随处可见。记得小时候的那些日子,邻里之间的欢声笑语、门前的小花小草,都是我们对于家的美好回忆。然而,随着社会的发展,很多老旧小区由于设施老化、环境恶化、功能不全等问题,亟待进行改造。尤其是小区里那些“违章搭建”的建筑,更是在这个过程中成为了一个重要的话题。那么,为什么老旧小区改造 2025-04-01 08:50:04
白鹤芋为什么不开花(白鹤芋不开花别急着扔)
这个网友猜的问题其实正中白鹤芋的弱点,白鹤芋也叫“白掌”,因为开花难而又名“安祖花”。但其实白鹤芋是个好养的植物,只要遵照养花性格,它一定能有自己的美丽绽放。那么白鹤芋经过什么过程才能开花呢?对于网友提出的问题,应该如何回复才算准确呢?关于白鹤芋。白鹤芋又名白掌、安祖花,属于一种天南星科花卉植物,原 2025-04-01 06:57:30
小区为什么要物业(小区为什么离不开物业公司?)
【引言】最近这几年,越来越多业主对物业的服务感到不满,不仅服务差、收费高,那服务态度更是一言难尽,明明自己是花钱买服务可最后服务不满意还要受一肚子的气,为此更是有不少业主嚷嚷着要“取消物业”。可就目前来看绝大多数小区都不具备取消物业的条件,贸然取消到最后难受的可能还是业主自己,毕竟物业服务的专业性、 2025-04-01 05:12:02
为什么五月不动土(为何五月不能建房?)
在古代的时候,古人是十分避讳五月份的,甚至可以说是对五月份是有点害怕的,就是因为这个月份有太多的忌讳了。在民间就有一种说法,这也是古人传下来的,那就是“五月不起屋,起屋主发秃”。这里的五月也是指农历五月份,它的意思是说最好不要在农历五月份建房子,如果一定要在这个月份建房子,那房子主人就容易秃顶。这又 2025-04-01 02:09:52
为什么石墨能导电(石墨材料的物理性质有哪些?)
石墨材料具有一系列独特的物理性质,主要包括以下几点:颜色与外观:石墨呈深灰色至黑色,具有金属光泽,质软且滑腻。导电性和导热性:石墨是一种良好的导体,其导电性优于一般的非金属材料,但略低于金属导体。此外,石墨的导热性也非常好,其导热系数远高于一般的非金属材料,甚至可以达到某些金属材料的水平。耐高温性: 2025-03-31 09:28:32